Принцип метода проточной цитометрии
1 Описание метода
Проточная цитометрия (другое название проточная цитофлюориметрия, Flow cytometry) – это измерение химических и физических свойств клеток по мере того, как клетки “протекают” одна за одной через точку интеграции, которой наиболее часто является лазер. Поскольку клетки рассеивают лазерный свет в различных направлениях, то свойства клеток, такие как их относительный размер и сложность структуры цитоплазмы, могут быть измерены. В цельной крови человека лимфоциты, моноциты, и гранулоциты могут быть различимы друг от друга просто потому, что рассеивают лазерный свет различным образом.
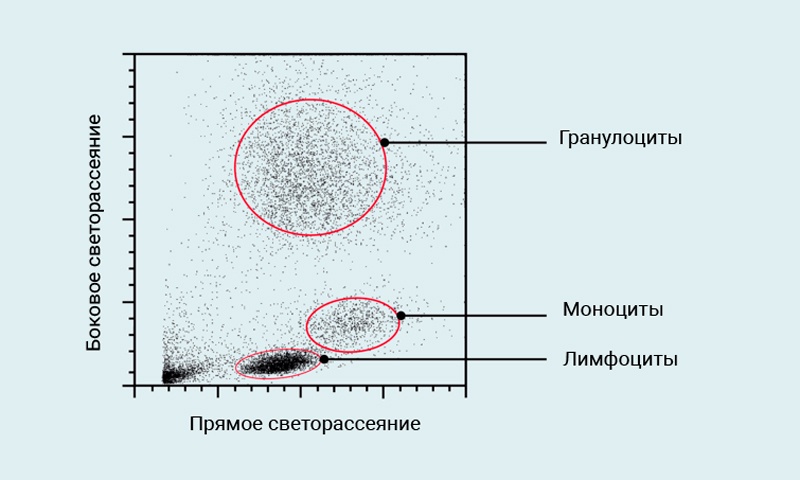
Рис. 1 Типичный профиль светорассеяния лизированной цельной крови
Большинство современных проточных цитометров могут измерять внешние клеточные свойства (экспрессию маркеров клеточной поверхности) или экспрессию внутриклеточных маркеров, содержание нуклеиновых кислот, активность ферментов и многое другое. Чтобы исследовать эти клеточные особенности, используются флуоресцентные реагенты, такие как антитела, конъюгированные с флуорохромом. Эти реагенты имеют характерные свойства светоизлучения, так что они могут быть обнаружены отдельно в различных параметрах флуоресценции.
Уникальным атрибутом проточной цитометрии является то, что флуоресценция на клеточном уровне или уровне частиц может быть измерена очень быстро. Когда флуоресцентно меченные клетки или частицы проходят через луч света, флуоресцентные зонды возбуждаются. Обнаружение испускаемого света и, в конечном счете, определенных клеточных свойств происходит со скоростью 10000 событий / секунду.
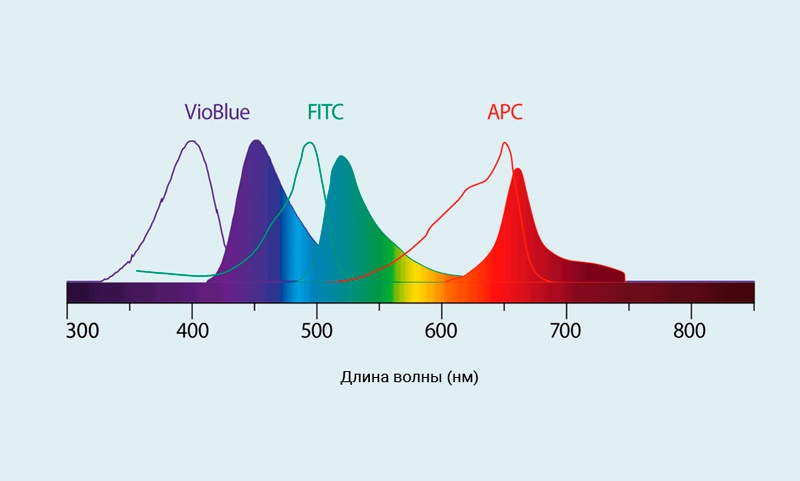
Рис.2 Спектры возбуждения и испускания для флуорохромов VioBlue®, FITC, and APC.
- Сплошные линии: спектр возбуждения
- Площадь залитая цветом: спектр испускания
- FITC = Максимум возбуждения (Ex):495 нм, максимум эмиссии (Em):519 нм
- APC = Максимум возбуждения (Ex):650 нм, максимум эмиссии (Em):660 нм
- VioBlue = Максимум возбуждения (Ex):400 нм, максимум эмиссии (Em):452 нм
Проточная цитометрия используется как в клинических, так и в фундаментальных исследованиях: иммунология, трансплантация, гематология, неврология, исследования стволовых клеток, онкология, клеточная биология, молекулярная биология, разработка лекарственных препаратов, системная биология, морская биология, микробиология, вирусология и многие другие. Клинические исследования включают, в частности, диагностику in vitro, исследования в контексте испытаний или мониторинг пациентов после лечения. Некоторые клиники также используют проточную цитометрию для характеристики клеток донора и реципиента перед трансплантацией, чтобы снизить риск побочных эффектов после трансплантации.
2 Примеры применения проточной цитометрии
- Многоцветное иммунофенотипирование.
- Оценка жизнеспособности клеток и выявление апоптоза с помощью конъюгатов c иодидом пропидия (PI) и аннексином V.
- Внутриклеточное обнаружение цитокинов и факторов транскрипции.
- Измерение секреции цитокинов с помощью наборов по анализу секреции цитокинов (MACS® Cytokine Secretion Assays).
- Анализ клеточного цикла с использованием иодида пропидия (PI) и/или бромдезоксиуридина (BrdU).
- Анализ микровезикул.
- Подсчет клеток.
- Измерение транспорта ионов (например, ионов кальция).
- Обнаружение активных форм кислорода и активных форм азота (окись азота; NO) c помощью флуоресцентных индикаторов H2DCFDA и DAF-FM diacetate, соответственно.
- Анализ клеточной пролиферации с помощью флуоресцентных меток CFSE или CMFDA.
- Определение флуоресцентных репортерных белков: GFP, CYP, YFP, tdTomato, mCherry, RFP.
- Анализ вирусных частиц, бактерий, митохондрий.
3 Принцип работы проточного цитометра
Проточный цитометр, например MACSQuant от Miltenyi Biotec, основан на системе, объединяющей флюидику, оптику и электронику.
- Флюидика (гидрофокусировка): система потока жидкости для выравнивания и перемещения клеток или частиц, проходящих сквозь путь лазерного луча
- Оптика: серия оптических фильтров и зеркал для направления света определенных длин волн, излучаемого клетками или частицами, к детекторам, которые анализируют световой сигнал.
- Электроника: интерфейс между оптикой и компьютером, преобразующий световые сигналы в электронный вид, позволяющий графическое построение.
3.1 Система флюидики
Гидродинамическая фокусировка используется для выравнивания и перемещения клеток или частиц через луч лазера. Жидкость протекает с постоянным давлением через проточную кювету. Клетки вводятся в середину потока обтекающей жидкости. По принципу ламинарного потока образцы клеток и обтекающая жидкость движутся в одном направлении, но остаются разделенными. Перепад давления между обтекающей жидкостью и образцами клеток определяет, насколько широк поток пробы по мере ее прохождения через проточную ячейку. Лазеры возбуждают флуоресцентно меченные клетки или частицы по отдельности, затем измеряются флуоресценция и светорассеяние.
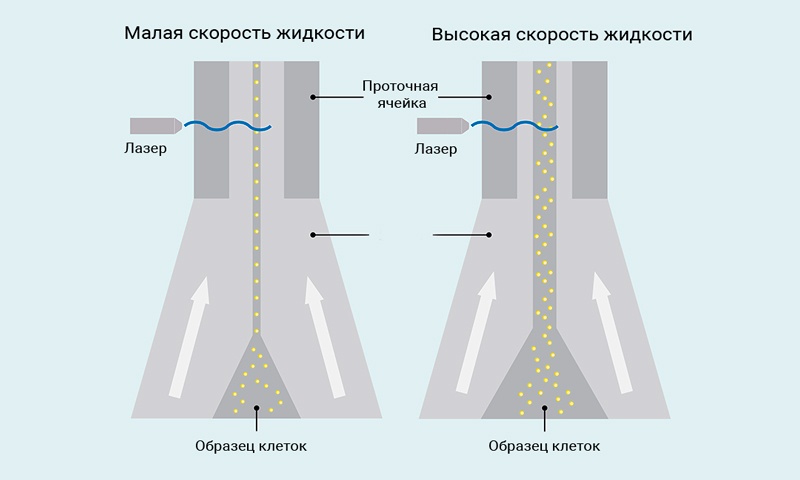
Рис.3 Иллюстрация гидродинамической фокусировки прибора MACSQuant®
В исследованиях с применением проточной цитофлюориметрии, которые требуют очень высокого разрешения определенных популяций клеток, например, для анализа клеточного цикла, низкая скорость жидкости рекомендуется для генерирования узкого потока образца. Для применений в обычном иммунофенотипировании, любая скорость жидкости является подходящей. Однако важно, чтобы настройка скорости событий прибора не превышала 10000 событий в секунду для любой из скоростей потока.
3.2 Оптическая система
3.2.1 Фильтры и зеркала
После возбуждения лазером флуоресцентные реагенты, связанные с клетками или частицами, излучают свет, который обнаруживается в соответствии с их конкретным диапазоном длин волн. При использовании комбинации флуоресцентных красителей эти реагенты должны иметь отличающиеся спектры излучения. В системах MACSQuant используются различные оптические фильтры и дихроичные зеркала для направления света с определенной длиной волны на соответствующие флуоресцентные детекторы. Такое расположение создает так называемые каналы флуоресценции.
Различные типы фильтров определяют, какие длины волн могут входить в каналы флуоресценции. По своим оптическим свойствам они относятся к коротковолновым пропускающим, длинноволновым пропускающим, и полосовым светофильтрам. Проточные цитометры MACSQuant используют длинноволновые пропускающие и полосовые светофильтры.
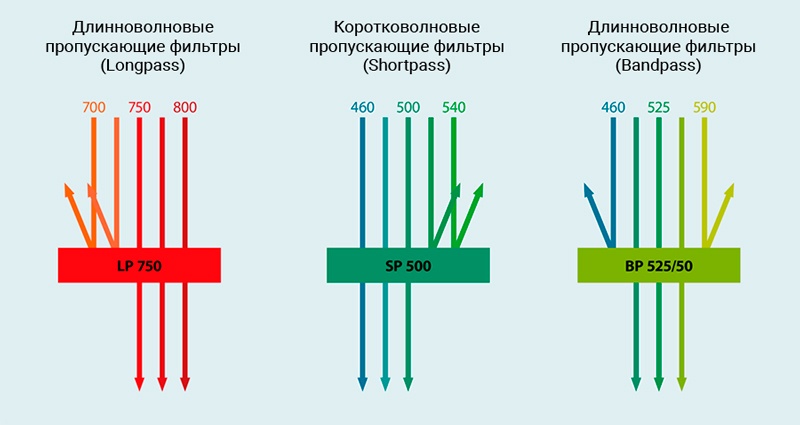
Рис.4 Оптические фильтры
Иллюстрация функции длинноволновых пропускающих (Longpass; LP), коротковолновых пропускающих (Shortpass; SP) и полосовых (Bandpass; BP) фильтров. Длинноволновые пропускающие фильтры блокируют свет до определенной длины волны, тогда как коротковолновые пропускающие фильтры пропускают свет до определенной длины волны. Полосовые фильтры пропускают свет в определенном диапазоне длин волн.
Длинноволновые пропускающие фильтры обозначаются буквами LP и конкретным числом, например, LP 750. Это означает, что свет с длинами волн 750 нм и более может проходить через фильтр. Свет всех других длин волн будет заблокирован. Коротковолновые пропускающие светофильтры имеют аналогичное обозначение, например, SP 500. В этом случае свет с длинами волн 500 нм и меньше может проходить, тогда как оставшийся свет будет блокирован. Полосовые фильтры пропускают свет с определенным диапазоном длин волн. Полосовые фильтры обозначаются через буквы BP, за которыми следуют два числа. Первое число представляет собой среднюю точку диапазона длин волн. Второе число указывает диапазон длин волн в нм, который может пройти. Таким образом, свет, который может проходить через фильтр BP 525/50, находится в диапазоне от 500 до 550 нм.
Дихроичные зеркала, по существу, выполняют ту же функцию, что и фильтры, но ориентированы под углом 45 ° к пути света, тогда как фильтры ориентированы перпендикулярно пути света. Свет, который не может пройти через дихроичное зеркало, отклоняется под углом 90 ° к другому детектору света.
Оптические системы проточных цитометров MACSQuant сочетают в себе три лазера, различные фильтры и зеркала, что дает до 14 отдельных каналов флуоресценции и два канала рассеяния.
3.2.2 Фотонные детекторы – фотоэлектронные умножители (PMTs)
Путь света определенных длин волн, то есть флуоресцентных каналов, контролируется фотоэлектронными умножителями (ФЭУ). ФЭУ усиливают флуоресцентный сигнал, испускаемый флуорохромом, связанным с клеткой или частицей, и генерируют электрический ток.
Величина усиления зависит от напряжения, приложенного к каждому ФЭУ. Когда напряжение увеличивается, усиление обнаруживаемой флуоресценции также увеличивается, что приводит к более высокой средней интенсивности флуоресценции (MFI). И наоборот, когда напряжение уменьшается, усиление также уменьшается, что приводит к снижению MFI. Электрический ток, генерируемый ФЭУ, преобразуется в импульс напряжения внутри электронной системы.
3.3 Электроника
Электронная система проточного цитометра преобразует световые сигналы в пропорциональные электронные сигналы (импульсы напряжения), оцифровывает сигнал в соответствии с разрядностью аналого-цифрового преобразователя (АЦП) и взаимодействует с компьютером для передачи данных.
Преимущества цифровых проточных цитометров включают в себя:
- Высота, ширина и площадь импульса напряжения могут быть измеримыми параметрами.
- Компенсация спектрального перекрытия применяется после цифрового преобразования сигнала, что означает, что компенсация может быть перенастроена в любое время после получения результата.
- Пороги обнаружения или переключатели могут быть установлены на любом из каналов обнаружения.
- Значения флуоресценции, обнаруженные как ноль или отрицательные значения, будут измерены как таковые и могут отображаться в получаемой диаграмме.
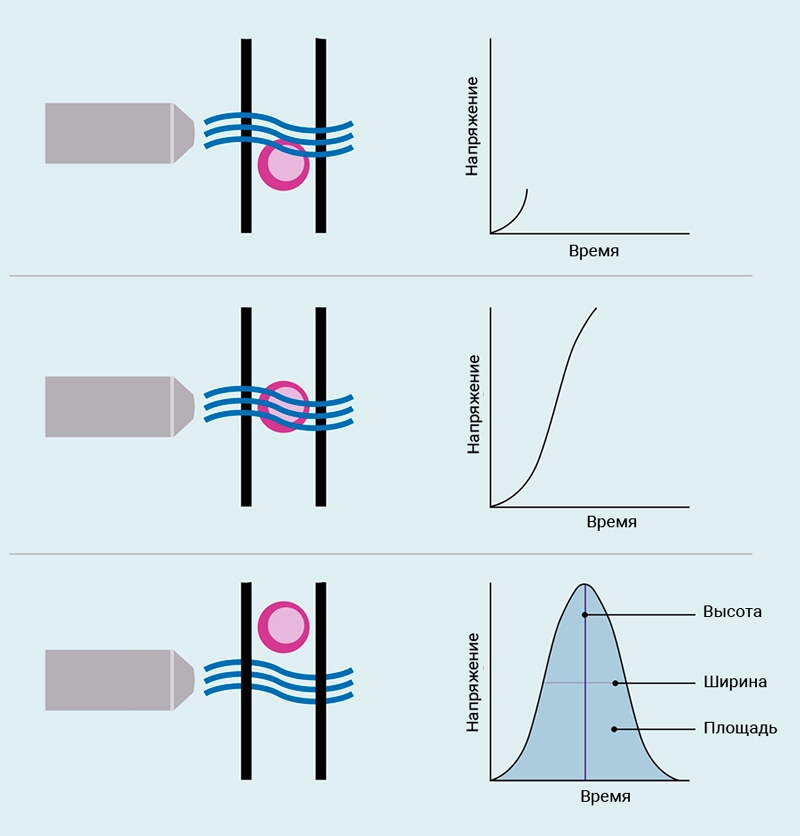
Рис.5. Импульс напряжения
Когда клетка проходит сквозь луч лазера, прикрепленный флуорохром начнет флуоресцировать. Этот свет обнаруживается ФЭУ и запускает генерацию импульса напряжения. Когда клетка полностью входит в луч лазера, флуоресценция достигает пика излучения, что приводит к наибольшему пику импульса напряжения. Наконец, когда клетка покидает лазерный луч, обнаруживаемая флуоресценция уменьшается, импульс напряжения пропадает.
Импульс напряжения характеризуется его высотой (интенсивностью сигнала), шириной (интервалом времени) и площадью (излучаемая флуоресценция при прохождении клетки через лазерный луч).
Далее аналоговые сигналы преобразуются в цифровые сигналы для отображения данных в соответствии с разрядностью АЦП. Системы MACSQuant имеют 16-битный АЦП для всех параметров. Для площади импульса применяются дополнительные вычисления с 18-битной обработкой. Это означает, что для измерений площади импульса сигнал разлагается на более чем 253 000 частотных полос. Это позволяет использовать для отображения данных логарифмическую шкалу вплоть до пяти порядков.
4 Визуализация данных проточной цитометрии
Для визуализации данных значения каждого измеренного оптического параметра могут быть нанесены на график различными способами. Эти графики могут быть одномерными (гистограммы) или двумерными (точечные диаграммы).
4.1 Одномерные графики — гистограммы
Одномерные графики позволяют визуализировать один оптический параметр события (флуоресценции или рассеяния света). Для каждого события значения интенсивности сигнала каждого измеренного параметра сохраняются в файле данных. Когда события начинают накапливаться, генерируется «кривая», которая описывает распределение измеренных событий в соответствии с интенсивностью их сигнала.
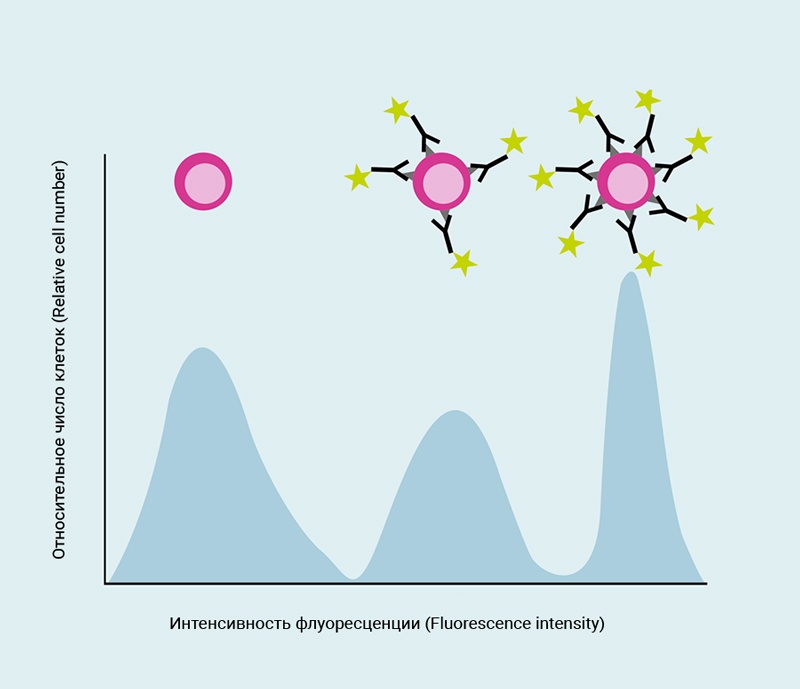
Рис.6 Гистограмма, показывающая интенсивность флуоресценции в зависимости от количества событий
Интенсивность нанесенных на график сигналов увеличивается слева направо, т.е. клеточные популяции слева показывают меньшую интенсивность сигнала, чем популяции справа.
Одномерная гистограмма показывает распределение интенсивности флуоресценции.
4.2 Двумерные диаграммы — точечные диаграммы
Точечные диаграммы позволяют визуализировать два оптических параметра на одном графике. Положение события определяется двумя значениями, то есть интенсивностями сигнала для оптических параметров, отображаемых на осях x и y. Когда все события нанесены на график, события с аналогичными значениями интенсивности накапливаются в кластерах, которые могут представлять определенные клеточные популяции.
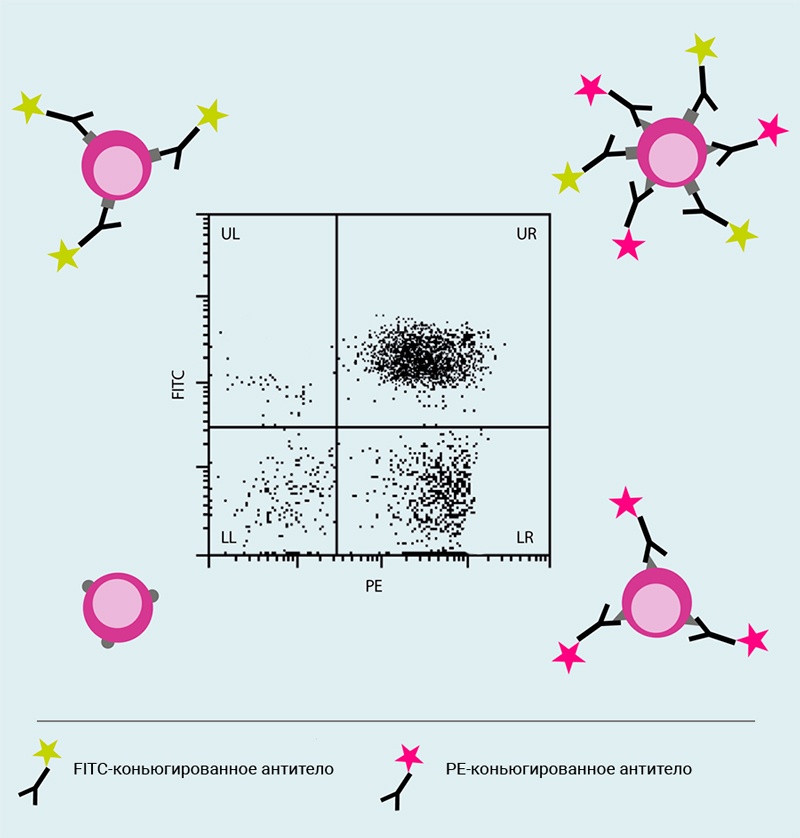
Рис.7 Точечная диаграмма, отображающая интенсивность двух параметров флуоресцентных сигналов
Двумерные точечные диаграммы позволяют одновременно визуализировать два оптических параметра.
На этом точечном графике клетки анализировали с использованием антител, конъюгированных с флуорохромами FITC и PE. График показывает клеточные популяции, которые являются либо отрицательными по обоим параметрам (нижний левый квадрант, LL), либо положительными по одному параметру (верхний левый (UL) и нижний правый (LR) квадранты), либо положительные по обоим параметрам (верхний правый квадрант, UR).
4.3 Двумерные диаграммы — диаграммы плотности
Диаграммы плотности отображают два параметра в виде распределения по частоте событий подобно точечной диаграмме, где каждой клетке соответствует точка. Кроме того, этот тип диаграмм изображает распределение клеток внутри популяции, характеризующейся очень высокой плотностью событий.
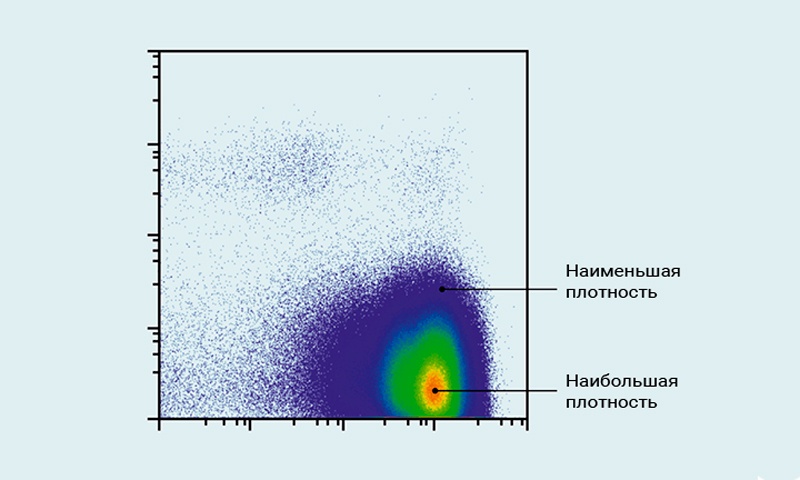
Рис.8 Диаграмма плотности
Диаграмма плотности показывает распределение клеток внутри популяции.
На этом графике плотности красный цвет представляет наибольшую плотность событий в клеточной популяции. С уменьшением плотности цвет переходит от желтого через зеленый к синему.
5 Источники
- www.miltenyibiotec.com
- www.bosterbio.com
3 «Flow cytometry in the analysis of cellular populations» — Handbook of instrumental techniques from CCiTUB
4 «Guide to Flow Cytometry» — Dako, Sonja Wulff, Colorado, USA



